a. 10 bulan
b. 8 bulan
c. 7 bulan
d. 6 bulan
e. 5 bulan
Jawaban : C
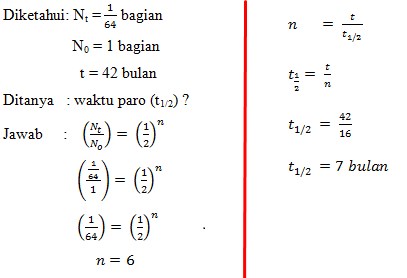
2. Suatu reaksi redoks : aBr2 (aq) + bOH– (aq) → cBrO3– (aq) + dBr–(aq) + eH2O (l)
Harga a, b, c dan a berturut-turut agar reaksi redoks di atas setara adalah ….
A. 3, 6, 1, 5, 3
B. 3, 6, 5, 1, 3
C. 6, 1, 5, 3, 3
D. 6, 1, 3, 5, 3
E. 1, 5, 3, 6, 3
Jawaban : A
Pembahasan:
3Br2 (aq) + 6OH– (aq) → 1BrO3– (aq) + 5Br– (aq) + 3H2O (l)
1. Dalam unsur logam alkali yang merupakan reduktor terkuat adalah….
a. Cs
b. Rb
c. K
d. Na
e. Li
Jawaban: E
Pembahasan
Besarnya harga potensial oksidasi standar logam alkali menunjukkan bahwa logam alkali merupakan reduktor yang kuat. Dari Na ke Cs kekuatan reduktornya makin kuat.
Tampaknya, hal ini bertentangan dengan besarnya Eo oksidasi Li à Li+ + e yang paling besar (3,05 volt). Hal ini dapat dipahami sebagai berikut:
Eneregi ionisasi adalah energy yang diperlukan untuk melepaskan electron dari atom-atom yang berwuwjud gas.
a. RbOH
b. CsOH
c. NaOH
d. KOH
e. LiOH
Jawaban: B
Pembahasan:
Dalam satu golongan alkali, dari atas ke bawah jari-jari atom semakin panjang, sehingga ketika membentuk basa semakin ke bawah semakin mudah melepaskan ion OH– .
1. Unsur-unsur periode 3 terdiri atas Na, Mg, Al, Si, P, S, Cl, dan Ar. Berdasarkan konfigurasi elektronnya, maka ….
a. Na,Mg, dan Al adalah unsur nonlogam
b. Oksida dari Si bersifat basa dalam air
c. Hidroksida dari P,S, dan Cl cenderun membentuk asam
d. Klor bersifat pereduksi kat
e. Jari-jari atom Ar paling besar
Jawaban : C
Pembahasan :
- Na,Mg,dan Al adalah unsur logam
- Oksida Si dalam air bersifat asam lemah :
- Senyawa hidroksida P,S, dan Cl bersifat asam
- Klor adalah oksidator terkuat pada periode ketiga
- Jai-jari Ar paling kecil pada periode ketiga
a. kerapatan semakin kecil
b. titik didih semakin kecil
c. kekerasan semakin besar
d. jari-jari logam semakin kecil
e. jari-jari ionic semakin kecil
Jawaban: B
Pembahasan
Kecenderungan sifat alkali sangat beraturan. Dari atas ke bawah, jari-jari logam, jari-jari ion dan massa jenis (rapatan) bertambah, sedangkan kekerasan, titik cair dan titik didih berkurang. Sementara itu energy pengionan dan keelektronegatifan berkurang. Potensial electrode dari atas ke bawah cenderung bertambah kecuali litium. Litium memiliki potensial electrode yang paling besar.
a. Na, Cl, Mg, P
b. Cl, P, Mg, Na
c. Cl, P, Na, Mg
d. P, Cl, Na, Mg
e. Na, Mg, P, Cl
Pembahasan :
Urutan unsur periode ketiga dari kiri ke kanan : Na, Mg, Al, Si, P, S, Cl, Ar. Salah satu perubahan sifat unsur periode ketiga dari kiri ke kanan adalah makin mudah tereduksi, berarti sifat oksidator bertambah.
Sebaliknya, sifat reduktor (pereduksi) berkurang. Dengan demikian, untuk sifat pereduksi yang makin besar urutannya adalah : Cl, P, Mg, Na.
Jawaban : B
- (1) Bahan pelapis besi
- (2) Penghantar Listrik
- (3) Bahan bangunan
- (4) Bahan penguat
- (5) Bahan agar menjadi bercahaya
Yang merupakan fungsi dari titanium adalah….
a. 1 dan 2
b. 2 dan 3
c. 3 dan 4
d. 4 dan 5
e. 1 dan 5
Jawaban: D
a. AgNO3 dalam NaOH
b. CuO dalam NaOH
c. AgNO3 dalam HCl
d. CuO dalam HCl
e. Cu2O
Jawaban : A
Pembahasan :
Selain dengan pereaksi Fehling, identifikasi aldehida dapat dilakukan dengan pereaksi Tollens, yaitu AgNO3 dalam NaOH . Hasil reaksi ditandai dengan terbentuknya endapan cermin perak
a. Polivinil Klorida
b. Poliester
c. Teflon
d. Polistirena
e. Polietena
Jawaban : B
Pembahasan :
Berdasarkan reaksi pembentukannya, polimer dibedakan atas 2, yaitu :
- Polimer adisi adalah polimer yang monomernya mempunyai ikatan rangkap, kemudian ikatan rangkapnya terbuka lalu berikatan membentuk polimer yang berikatan tunggal.
Contoh : Polivinil Klorida, Teflon, Polistirena, Polietena, Poliisoprena
- Polimer kondensasi adalah polimer yang monomernya mempunyai dua gugus fungsi pada kedua ujung rantainya kemudian saling berikatan sambil melepas molekul kecil.
Contoh : nilon, dakron (poliester), bakelit
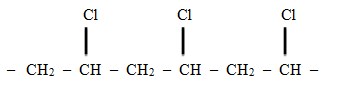
Adalah ….
a. CH2 = CH2
b. CHCl = CHCl
c. CH2 = CHCl
d. CH3 – CHCl – CH3
e. CH3 – CH2Cl
Jawaban : C
Pembahasan :
Monomer dengan struktur diatas adalah polimer dari Polivinil Klorida, yang mana monomernya apabila disingkat menjadi :
![]()
Tidak ada komentar:
Posting Komentar