a. Ca, Mg, Sr, Ba
b. Mg, Ca, Ba, Sr
c. Mg, Ca, Sr, Ba
d. Ba, Sr, Ca, Mg
e. Ca, Ba, Mg, Sr
Jawaban : D
2. Zat tunggal yang tidak dapat dibagi lagi menjadi zat yang lebih sederhana disebut . . . .
a. unsur
b. campuran
c. senyawa
d. larutan
Jawaban : A
Chapter 2
1. Berikut ini yang bukan merupakan senyawa ion adalah..
A. KlB. NH
C. NaCl
D. KCl
Jawaban: B
2. Dalam dua molekul senyawa Fe (SO) mengandung..
A. 2 atom Fe, 1 atom S, 12 atom OB. 4 atom Fe, 2 atom S, 24 atom O
C. 2 atom Fe, 3 atom S, 12 atom O
D. 4 atom Fe, 6 atom S, 24 atom O
Chapter 3
Jawaban : E
a. Jumlah maksimum produk reaksi ditentukan oleh pereaksi yang habis bereaksi
b. Produk reaksi hanya terbentuk dari bagian pereaksi yang berubah
c. Jumlah mol zat-zat tidak terlibat dalam reaksi
d. Tidak semua pereaksi yang tersedia bereaksi sesuai dengan perbandingan koefisien atau stoikiometri reaksinya
e. Semua salah
Jawaban : D
a. NH4+
b. H2O
c. HCO3–
d. CO32-
e. H2CO3
Pembahasan:
Berdasarkan teori Bronsted-Lowry, asam didefinisikan sebagai pendonor 1 ion H+ pada basa, dan basa didefinisikan sebagai penerima 1 ion H+ dari asam.
Spesi yang tidak memiliki atom H tidak dapat berperan sebagai pendonor H+, oleh karena itu spesi yang tidak berlaku sebagai asam Bronsted-Lowry ialah CO32-
Jawaban: D
2. Larutan CH3COOH 0,01 M ,Harga Ka = 1,8 x 10-5, nilai kosentrasi ion H+ larutan tersebut adalah……
a. 8 x 10-7
b. 4,2 x 10-4
c. 4,2 x 10-6
d. 2,4 x 10-4
e. 2,4 x 10-6
Pembahasan:
Jawaban: B
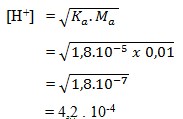
A. 1,00 . 10² Pa
B. 2,41 . 10² Pa
C. 6,02 . 10² Pa
D. 1,00 . 10^5 Pa
E. 2,41 . 10^5 Pa
Jawaban : D
2. Sebanyak 3 liter gas Argon bersuhu 27°C pada tekanan 1 atm( 1 atm = 105 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J mol−1 K−1 dan banyaknya partikel dalam 1 mol gas 6,02 x 1023 partikel, maka banyak partikel gas Argon dalam tabung tersebut adalah…..
A. 0,83 x 10²³ partikel
B. 0,72 x 10²³ partikel
C. 0,42 x 10²³ partikel
D. 0,22 x 10²³ partikel
E. 0,12 x 10²³ partikel
Jawaban : B
a. Entalpi pereaksi bertambah
b. Entalpi peraksi berkurang
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
e. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
Jawaban: D
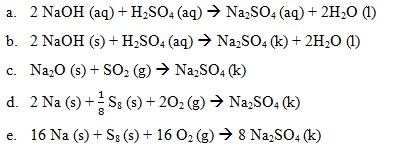
Jawaban : D
Chapter 7
1. Kalium mempunyai nomor atom 19 dan nomor massa 39. Jumlah elektron pada ion Kalium adalah . . .
A. 21
B. 20
C. 19
D. 18
E. 17
Jawaban : C
2. Pada isotop unsur ![]() , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Jawaban : C
Chapter 9
1. Diketahui beberapa unsur dengan konfigurasi electron sebagai berikut:
- P: 2 8 7
- Q: 2 8 8 1
- R: 2 8 18 2
- S: 2 8 8
- T: 2 8 18 4
Diantara unsur di atas, yang paling stabil (paling sukar membentuk ikatan kimia) adalah ….
a. P
b. Q
c. R
d. S
e. T
Jawaban : D
2. Diantara pasangan unsur berikut yang dapat membentuk senyawa ion adalah ….
a. C (Z = 6) dan Cl (Z = 17)
b. N (Z = 7) dan H (Z = 1)
c. C (Z = 6) dan O (Z = 8)
d. Mg (Z = 12) dan Cl (Z = 17)
e. P (Z = 15) dan O (Z = 8)
Jawaban : D
Chapter 10
1. Dipol permanen akan terdapat pada molekul ….
A. CH4
B. PCl3
C. BeCl2
D. CCl4
E. BCl3
Jawaban: B
A. Masa molekul relatif H2S lebih besar dari H2O
B. H2O membentuk ikatan hidrogen sedangkan H2S tidak
C. H2S lebih mudah terionisasi, dibanding H2O
D. Ikatan kovalen H2O lebih kuat dari H2S
E. Gaya van der Waals H2S lebih besar dari H2O
Jawaban: B
Chapter 11
1. Polarisabilitas paling mudah terjadi pada molekul . . . .
A. Massa molekul relatifnya kecil dan bentuk molekulnya panjang {lonjong}B. Massa molekul relatifnya besar dan bentuk molekulnya panjang {lonjong}
C. Massa molekul relatifnya besar dan bentuk molekulnya simetris
D. Massa molekul relatifnya kecil dan bentuk molekulnya simetris
E. Titik diih dan titik lelehnya paling rendah
B.NH3
C.H2O
D.C2H6
E.C2H5OH
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Jawaban : C
a. 64 %
b. 54%
c. 63%
d. 62%
e. 60%
Jawaban : A
Tidak ada komentar:
Posting Komentar