CHAPTER 13
1. Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
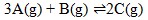
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Pembahasan :
Dengan menggunakan perbandingan koefisien maka :
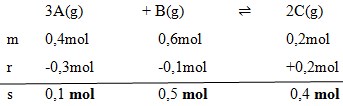
2. Kenaikan suhu akan mempercepat laju reaksi karena …
A. kenaikan suhu akan menyebabkan konsentrasi pereaksi meningkat
B. frekuensi tumbukan semakin tinggi
C. dalam reaksi kimia suhu berperan sebagai katalisator
D. kenaikan suhu akan mengakibatkan turunnya energi aktivasi
E. Energi kinetik partikel-partikel yang bereaksi semakin tinggi
Pembahasan :
Kenaikan suhu akan mempercepat laju reaksi dikarenakan energi kinetik partikel-partikel yang bereaksi semakin tinggi. Apabila suhunya menurun maka energi kinetik partikel-partikel yang bereaksi semakin kecil
CHAPTER 14
1. Agar pada reaksi kesetimbangan:
Jumlah gas NO yang dihasilkan maksimal, maka tindakan yang diperlukan adalah…
a. Menaikan tekanan
b. Menurunkan takanan
c. Mengecilkan volum
d. Menaikan suhu
e. Memperbesar volume
Pembahasan :
Menurut Azas Le Chatelier, jika sistem dalam kesetimbangan terjadi kenaikan suhu, maka akan terjadi pergeseran kesetimbangan kearah reaksi yang menyerap kalor (Apabila koefisien sama antara produk dan reaksi maka volume dan tekanan tidak mempengaruhi reaksi. Reaksi diatas termasuk reaksi endoterm jadi jika dinaikkan suhu maka kesetimbangan akan bergeser kearah reaksi endoterm atau bergeser kearah kanan (NO), jika reaksi bergeser kerah kanan maka nilai Kc akan semakin besar.
2. Pada suhu tertentu, dalam ruang 1 liter terdapat kesetimbangan:
Semula terdapat 0,5 mol gas SO3 dan setelah tercapai kesetimbangan perbandingan jumlah mol SO3 terhadap O2 adalah 4:3. Harga tetapan kesetimbangannya adalah…
a. 0,125
b. 0,3375
c. 0,187
d. 0,563
e. 1,687
pembahasan
CHAPTER 15
1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Pembahasan:
Teori asam Brosnted-Lowry:
Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
2. Larutan yang mempunyai pH lebih besar dari 7 adalah . . . .
a. Gula
b. Alkohol
c. Amoniak
d. Asam nitrat
e. Asam klorida
Pembahasan
pH gula adalah netral(pH=7), sedangkan asam memiliki pH<7, pH alkohol adalah hampir netral 7,33. Amoniak merupakan basa, yang memiliki pH=12. Sehingga larutan yang mempunya pH lebih besar dari 7 adalah amoniak
CHAPTER 16
1. Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebagai…
a. [Ag] [CrO4]
b. [Ag+] [CrO4-2]
c. [Ag+]2 [CrO4-2]
d. [Ag+] [CrO–]4
e. [Ag4+]2 [CrO2]4
Pembahasan:
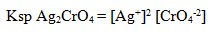
2. Campuran berikut ini yang dapat membentuk larutan penyangga adalah ….
A. 100 mL NaOH 0,1 M + 100 mL HCl 0,1 M
B. 100 mL NaOH 0,1 M + 100 mL NaCN 0,1 M
C. 100 mL NaCN 0,1 M + 100 mL HCN 0,1 M
D. 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
E. 100 mL K2SO4 0,1 M + 50 mL H2SO4 0,1 M
Pembahasan :
Asam-asam maupun basa yang terlibat memiliki valensi yang sama, satu. Tinggal dilihat dari masing-masing campuran perbandingan molnya untuk melihat ada tidaknya sisa dari asam lemah atau basa lemahnya.
>>NaOH ( basa kuat) dan HCl (asam kuat)
>>NaOH (basa kuat) dan NaCN (garam)
>>NaCN (garam) dan HCN (asam lemah)
>>NH4OH (basa lemah) dan H2SO4 (asam kuat)
>>K2SO4 (garam) dan H2SO4 (asam kuat)
>>Pilihan c dan d memiliki asam lemah dan basa lemah jadi dilihat perbandingan molnya untuk melihat ada tidaknya sisa dari asam lemah atau basa lemahnya
CHAPTER 17
1. Dewasa ini lapisan ozon di stafosfer berkurang karena terkontaminasi oleh kloro fluro karbon yang dikenal dengan nama…..
A. Eter
B. Freon
C. Benzene
D. Aerosol
E. Methanol
Pembahasan :
Gas yang mampu merusak ozon pada lapisan stratosfer adalah Gas CFC (Chloro Fluoro Carbon) atau yang sering kita sebut gas Freon. Pengambilan nama gas Freon sendiri berdasarkan salah satu merek dagang dari E.I du Pont de Nemours dan Company yaitu merupakan bahan baku pembuatan pendingin baik dalam bentuk cair maupun gas.
2. Suatu campuran pereaksi di dalam tabung reaksi meyebabkan tabung tersebut menjadi panas jika dipegang. Penyataan yang tepat mengenai hal tersebut adalah….
a. Entalpi pereaksi bertambah
b. Entalpi peraksi berkurang
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
e. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
Pembahasan:
Jika suatu reaksi kimia menghasilkan panas, maka reaksi tersebut merupakan reaksi eksoterm. Pada reaksi eksoterm, entalpi reaksi bernilai negative (entalpi pereaksi lebih besar daripada entalpi hasil reaksi)
CHAPTER 18
1. Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Pembahasan
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO
2. 1,5 m3 gas helium yang bersuhu 27oC dipanaskan secara isobarik sampai 87oC. Jika tekanan gas helium 2 x 105 N/m2 , gas helium melakukan usaha luar sebesar…
A. 60 kJ
B. 120 kJ
C. 280 kJ
D. 480 kJ
E. 660 kJ
Pembahasan:
V1 = 1,5 m3
T1 = 27oC = 300 K
T2 = 87oC = 360 K
P = 2 x 105 N/m2
W = PΔV
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ.
![]()
![]()



Tidak ada komentar:
Posting Komentar